科研动态
51直播
Cell Stem Cell| 邓宏魁团队在化学重编程领域取得新成果:首次实现将人体血液细胞化学重编程为多能干细胞
2025年7月30日,51直播-51直播网 邓宏魁课题组与北京大学药51直播 关景洋课题组合作,在国际学术期刊Cell Stem Cell上发表了题为“Chemical Reprogramming of Human Blood Cells to Pluripotent Stem Cells”的最新研究成果。该研究首次实现了利用化学方法将人血液细胞诱导为多能干细胞,克服了化学诱导多能干细胞制备中起始细胞来源的关键瓶颈,将进一步推动化学诱导多能干细胞技术的可及性。

图1. 本报道原始论文51直播截图
多能干细胞(Pluripotent stem cells)具有自我更新及分化成不同功能细胞的潜力,是再生医学的核心种子细胞。化学重编程技术是一种新型的细胞命运重编程方法,它利用化学小分子组合来精准操控细胞命运,为多能干细胞的制备提供了全新的途径。邓宏魁团队于2013年首次实现了完全利用化学小分子将小鼠体细胞重编程为多能干细胞(Science,2013)。相比于传统的转录因子重编程策略,小分子重编程提供了更灵活、更简便的细胞命运调控方式。该团队后续还深入地系统性阐述了化学重编程的独特分子路径(Cell, 2015; Cell Stem Cell, 2018),揭示了化学重编程技术与传统转基因重编程策略在机制上的本质差异。
2022年,邓宏魁团队成功将该技术应用于人体细胞,首次制备了化学诱导人多能干细胞(hCiPS细胞),这一突破为化学重编程技术应用于人体疾病治疗奠定了基础(Nature,2022)。随后,该团队开发了更加高效、化学成分明确的hCiPS细胞诱导体系,使该技术制备的多能干细胞更符合临床应用需求(Cell Stem Cell, 2023)。近期,通过克服关键的表观遗传障碍,团队进一步建立了快速的化学重编程平台,能高效地将人成体细胞转化为hCiPS细胞 (Nature Chemical Biology, 2025)。值得注意的是,人体细胞化学重编程过程经历分阶段诱导,在此过程中会产生短暂激活的、模拟逆向发育通路的类再生状态(Cell Reports, 2023; Cell Stem Cell, 2024)。这一机制进一步揭示了化学重编程的独特原理,使其成为一个高效可控的细胞命运调控体系,在临床方面具有广阔应用前景。
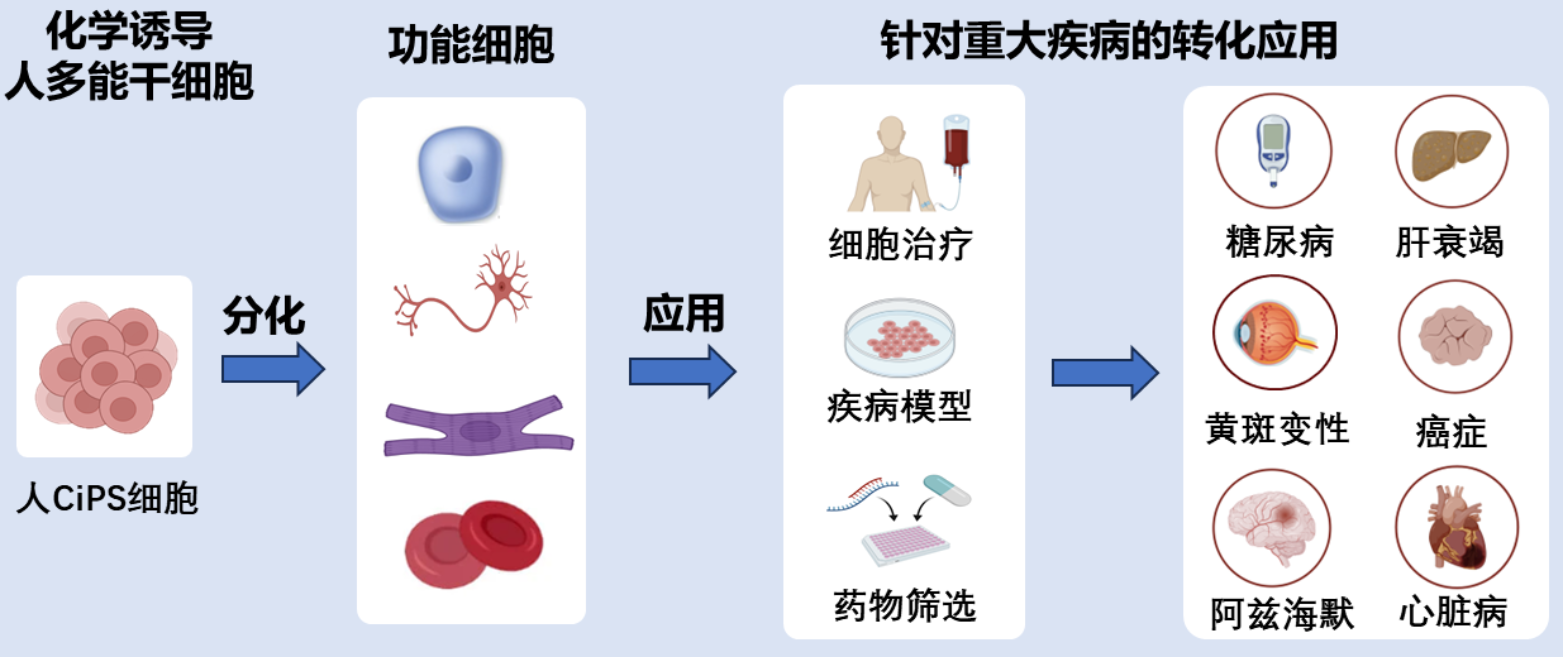
图2. 化学诱导人多能干细胞的应用前景
尽管在人体细胞化学重编程领域取得了诸多进展,但仍然存在一个重要挑战:寻找理想的用于重编程的人体细胞来源。皮肤成纤维细胞和脂肪基质细胞虽为常用来源,但其他类型的体细胞——特别是人类血细胞——能否通过化学重编程成功转化为hCiPS细胞,此前仍是未知数。与其它体细胞类型相比,血液细胞是最易获取、最便捷且近乎无限的组织来源。采血程序成熟、不易污染且对患者和捐献者侵入性小。更重要的是,血库中储存着大量可用于研究和应用的冻存血液样本。因此,开发一种能够从血液细胞稳定、高效制备hCiPS细胞的化学重编程策略具有重要的意义,这将克服现有化学重编程技术的局限,促进其在个体化再生医学中的广泛应用。
本研究中,团队成功克服了化学重编程技术的关键挑战,建立了将人脐带血和成人外周血细胞重编程为hCiPS细胞的方法。这一新型化学重编程体系,可以在20天内诱导单孔数百个hCiPS克隆的产生,最快仅需12天诱导。同时,该技术方案还可以稳定地从冷冻保存的血细胞诱导获得hCiPS细胞,为利用大型外周血库和脐带血库规模化制备hCiPS细胞系奠定了基础。值得注意的是,团队还成功建立了基于少量指尖采血获得的细胞重编程为hCiPS细胞的体系,为大规模构建hCiPS细胞库提供了一种简单高效的策略。血液重编程方法显著地拓展了化学重编程技术的应用范围,首次实现了从人体最易获取且最丰富的组织样本中高效制备hCiPS细胞。
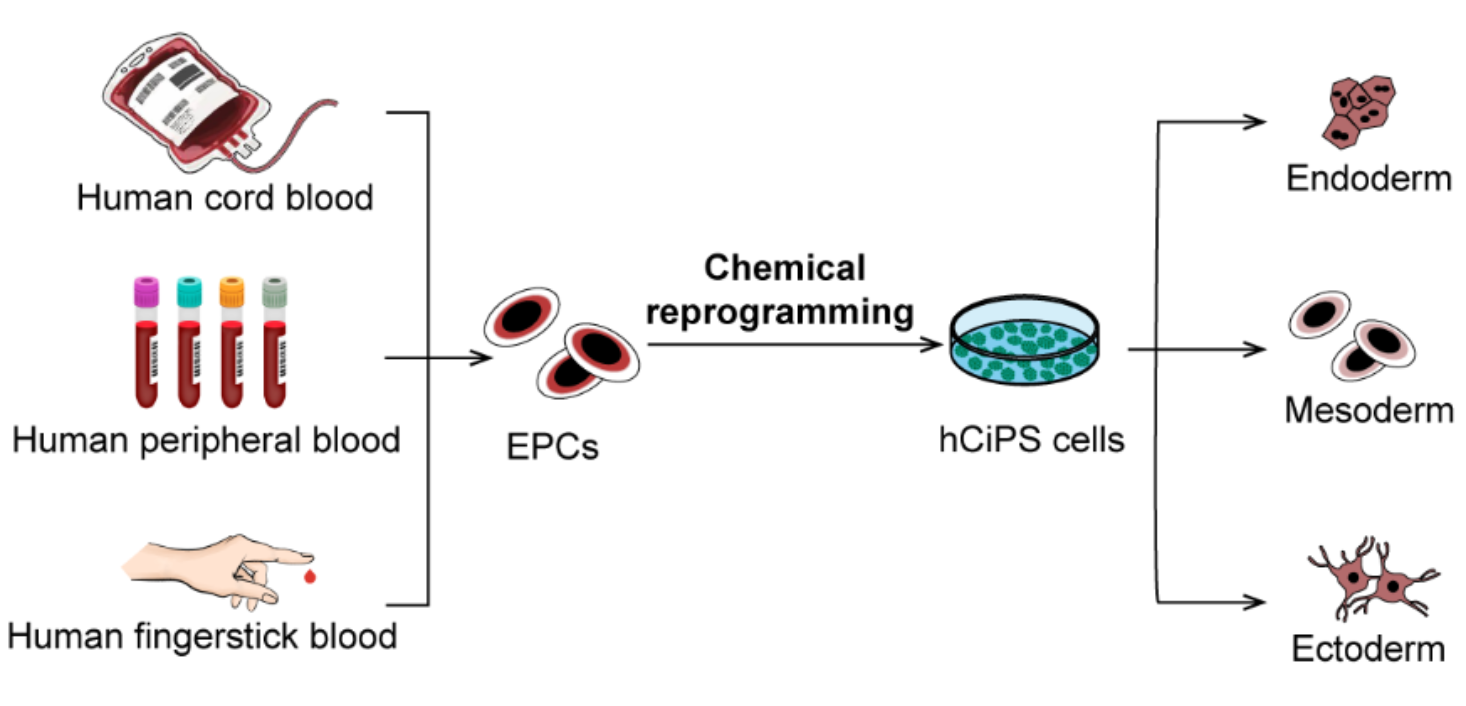
图3. 化学重编程诱导不同来源人血液细胞为多能干细胞
血液化学重编程体系代表了新一代的人多能干细胞制备技术,有潜力超越传统的转基因策略。本研究显示,对于同一供体来源的外周血单核细胞,化学重编程方法的效率比传统四因子重编程方法的效率高出20倍以上。此外,化学小分子方法简单易操作,无需递送任何外源基因,便于开发即用型试剂盒,易于广泛应用。相比之下,基于转录因子的方法在血细胞重编程中还存在一定局限。例如基于仙台病毒(sendai virus)和附加体载体(episomal vectors)的重编程方法,在血液细胞上诱导效率较低,且需要将已建立的细胞系进行多次传代,以消除外源重编程因子,才能用于进一步的应用。相比之下,化学重编程建立的hCiPS细胞系无需额外操作即可直接使用。鉴于这些优势,这种有效便捷的血细胞化学重编程方法有潜力成为被广泛使用的平台。
这一技术体系的建立,将进一步加速hCiPS细胞技术在临床应用上的推广和应用。近期,邓宏魁和其他课题组报道不同的功能细胞,例如胰腺细胞、肝脏细胞、T-NK细胞和视网膜色素上皮细胞等,都可以从hCiPS细胞高效分化获得。值得强调的是,邓宏魁团队研究结果表明,将hCiPS细胞来源的胰岛细胞移植到1型糖尿病患者体内,病人能够实现自主性生理性的胰岛调控,摆脱外源胰岛素,初步实现临床治愈(Nature Medicine, 2022; Nature Metabolism, 2023; Cell, 2024)。这些成果展示了化学重编程应用于重大疾病治疗方面的巨大潜力。结合本研究在血液重编程体系的突破,将进一步推进hCiPS细胞在重大疾病治疗法的可及性,也为化学重编程在再生医学中的广泛应用铺平了道路。
北京大学彭芳琪、王杨璐、成林、蔡如意、傅筱荻、杨芷涵、程若琦为该研究的共同第一作者。北京大学博雅讲席教授、昌平实验室领衔科学家邓宏魁教授、北京大学药51直播 关景洋研究员和王杨璐博士是这一研究成果的共同通讯作者。北京大学李程教授、北医三院穆荣主任为本研究提供了重要帮助。本工作获得了国家自然科学基金、北京市自然科学基金、中国博士后科学基金等支持。
原文链接://doi.org/10.1016/j.stem.2025.07.003

