科研动态
51直播
基因可塑性(gene plasticity)指基因在多个层次(DNA、RNA及蛋白质等)的变化和变异能力,是基因的基本属性。中心法则描述了遗传信息的传递方向,基因可塑性反映了遗传信息在传递过程中的变化幅度。基因可塑性是细胞表型异质性的基础。基于可塑性评分,基因可分为高可塑(HPG)和低可塑(LPG)两个主要类别,其随细胞表型分层而转变。全部可塑性集合构成可塑组(plasticitome)。自2013年以来,王平章对基因可塑性及其应用进行了系列探索,发表相关SCI论文20余篇,包括J Immunol.(4篇)、Nucleic Acids Res.、J Autoimmun.、Eur J Immunol.、Immunology等,揭示了基因可塑性在marker分子鉴定与评估、免疫细胞亚群鉴定及表型特征分析、共表型和互斥表型分析、基因表达负调控等方面的用途。
近日,Advanced Science杂志在线发表其研究论文Mutual Exclusion Analysis Shows that DUSP9 Negatively Regulates PD-L1 Expression and Acts as a Target to Enhance Anti-PD-1 Efficacy,该研究显示基因可塑性在基因表达互斥分析进而在负调控基因鉴定方面的显著优势,获得了系列PD-L1的互斥表达基因,深入研究了双特异性磷酸酶9(DUSP9)负调控PD-L1表达的分子机制;该研究提出基于可塑性的互斥干预(Mutual Exclusion interference,MEi)(中文谐音“魅”,寓意魅力)策略,证明其在肿瘤联合免疫治疗中的潜在应用价值,为鉴定免疫检查点抑制剂(ICI)治疗响应性标志分子和联合免疫治疗靶点筛选提供了新的研究方向。

免疫检查点阻断(ICB)疗法是肿瘤免疫治疗的一项革命性突破,然而其临床总体响应率仍较低。如何甄别ICB疗法的敏感人群,以及发展新的联合免疫治疗策略是当前肿瘤免疫治疗领域亟待攻克的课题。PD-L1的表达水平是临床广泛应用的ICB疗效预测指标,PD-L1高表达患者对PD-1/PD-L1抑制剂治疗响应更好。该研究基于基因可塑性分析从PD-L1的互斥表达基因入手建立科学假说,当这些互斥分子高表达时PD-L1低或无表达,从而可能导致肿瘤对PD-1/PD-L1抑制剂抵抗;另一方面,通过MEi策略干预这些互斥分子功能有望提高肿瘤对PD-1/PD-L1抑制剂的治疗敏感性。
该研究通过混合细胞表型增加PD-L1表达的可塑性,经过信息学分析和实验初筛后围绕DUSP9开展研究。通过过表达和敲减等实验手段证实DUSP9在多种人和小鼠肿瘤细胞中负调控PD-L1表达。机制研究表明DUSP9催化STAT3的Y705及S727位点去磷酸化从而抑制PD-L1表达。稳定敲低DUSP9表达可以抑制体外及免疫缺陷小鼠移植瘤模型中的多种肿瘤生长,但是在免疫功能健全小鼠中DUSP9稳定敲低导致PD-L1表达上调从而抵消其对肿瘤生长的抑制作用。给予PD-1抗体治疗时,DUSP9稳定敲低或接受siRNA联合治疗的肿瘤生长更为缓慢,表明靶向DUSP9和ICB疗法具有协同作用。头颈肿瘤临床标本分析表明,DUSP9在ICI无响应患者中的表达更高,提示DUSP9可能作为PD-1/PD-L1抗体治疗无响应的生物标志物。
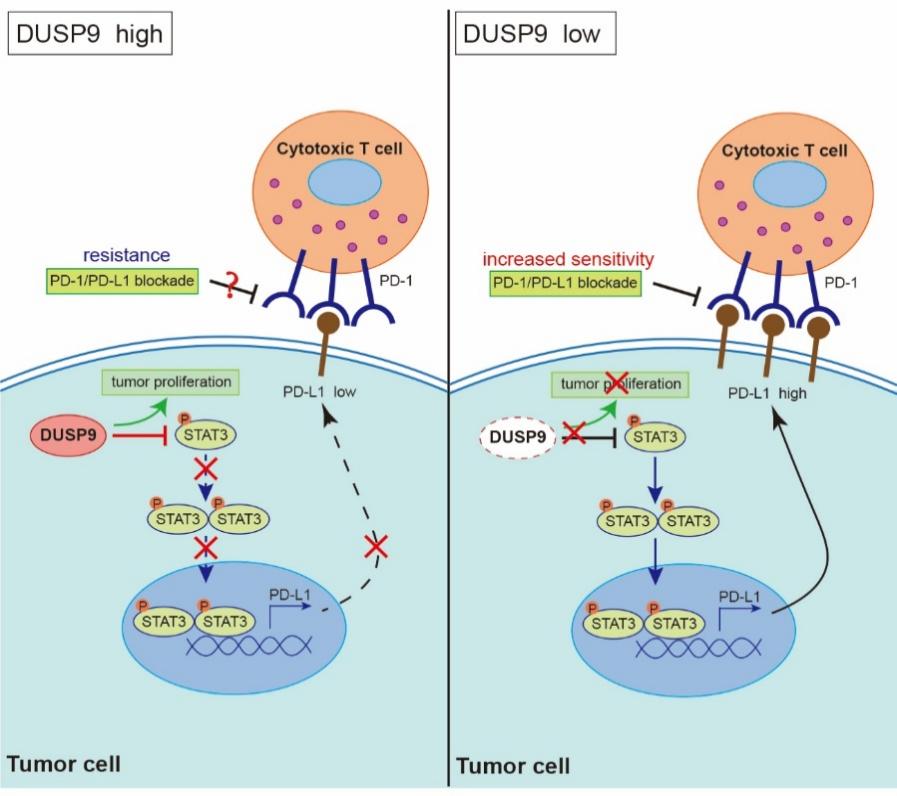
综上,该研究明确了DUSP9负调控PD-L1的分子机制及其在免疫治疗响应性预测和联合免疫治疗策略开发中的潜在应用价值,将有助于推动其他系列PD-L1互斥表达分子的研究和临床价值开发。
51直播-51直播网 免疫学系的博士毕业生胡玉喆为论文的独立第一作者;51直播-51直播网 免疫学系、北京大学人类疾病基因研究中心王平章副教授、韩文玲教授及首都医科大学附属北京同仁医院头颈外科郭伟主任医师为论文的共同通讯作者。
原文链接://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202514347

