51直播 新闻
Cell | 阿尔茨海默症治疗新突破:靶向胆囊收缩素受体Gq通路的偏好性小分子
51直播
阿尔茨海默病(AD)作为一种以记忆减退和认知功能下降为主要特征的神经系统退行性病变,近年来在全球范围内的发病率及死亡率持续攀升。随着病情发展,患者的认知与记忆功能不断恶化,最终将失去独立生活能力。目前临床上常用的AD治疗药物,如胆碱酯酶抑制剂和谷氨酸受体拮抗剂(例如美金刚),虽然能在一定程度上改善患者的认知状况[1-4],但无法有效遏制或延缓疾病的进程。而针对Aβ斑块清除的单克隆抗体疗法,则存在脑水肿等不良反应,且临床疗效有限[5]。在此背景下,开发全新的治疗策略显得尤为迫切。
神经肽在神经元突触功能中发挥着不可或缺的作用,广泛存在于中枢及外周神经系统,参与神经信号转导、突触可塑性调节以及神经内分泌调控,并兼具神经营养和保护功能[6]。胆囊收缩素(CCK)作为脑中含量最为丰富的神经肽之一,在神经传递以及情绪、学习记忆、焦虑与恐惧等高级脑功能中扮演关键角色[7-11]。CCK信号通路的核心机制在于其与B型胆囊收缩素受体(CCKBR)的特异性识别与结合。这一相互作用不仅是长时程增强(LTP)产生的必要条件,也对学习记忆等关键认知过程具有重要调控作用[12, 13]。值得注意的是,大脑中CCK存在多种亚型,可激活多条G蛋白信号通路,其中硫酸化CCK8(CCK8s)因含量最高,被视为最重要的内源性配体[11]。前期贺菊芳教授团队的研究发现,外源性CCK8s可显著提升老年大鼠的空间学习记忆能力,提示CCK信号通路可能成为AD治疗的潜在靶点。鉴于AD已成为全球老龄化社会面临的重大健康挑战,探索以CCKBR为靶点开发AD治疗药物具有重要的科学和临床意义。
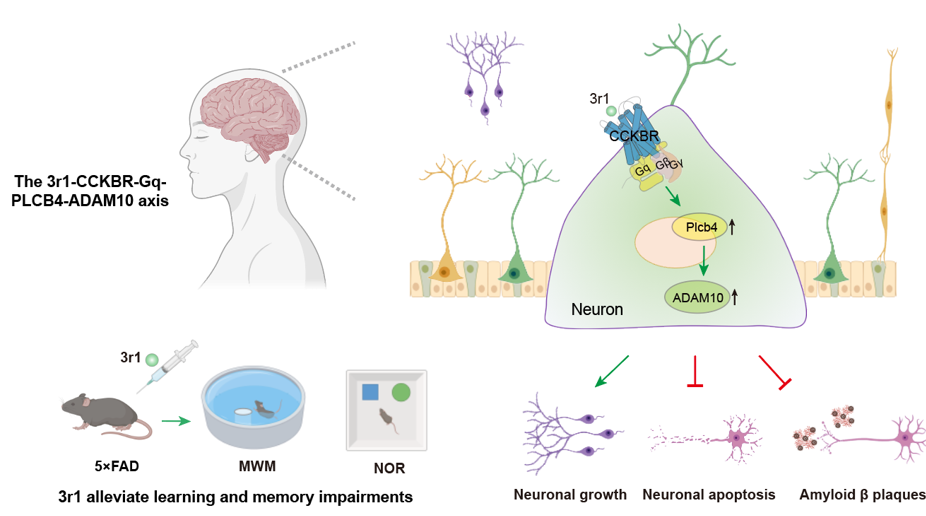
2025年11月21日,北京大学孙金鹏教授与香港城市大学贺菊芳教授,北京大学张勇教授,铁璐副教授,香港中文大学(深圳)杜洋教授,北京宣武医院唐毅主任通力合作,在Cell杂志上发表了题为“Elucidating pathway-selective biased CCKBR agonism for Alzheimer's disease treatment”的研究论文。该研究从临床问题出发,结合临床样本分析与动物模型,系统阐明了CCKBR下游不同G蛋白信号通路在AD进程中的作用;通过解析内源性激动剂CCK8s激活CCKBR不同G蛋白(Gs、Gq、Gi)的分子机制,揭示了其信号偏向性的结构基础,并以此为基础成功设计出具有治疗潜力的Gq偏向性激动剂3r1。进一步通过动物实验与转录组分析,研究团队证实3r1可通过CCKBR-Gq-Plcb4-Adam10信号轴减轻神经/突触损伤、清除Aβ沉积,为阿尔茨海默病的精准治疗提供了全新策略。

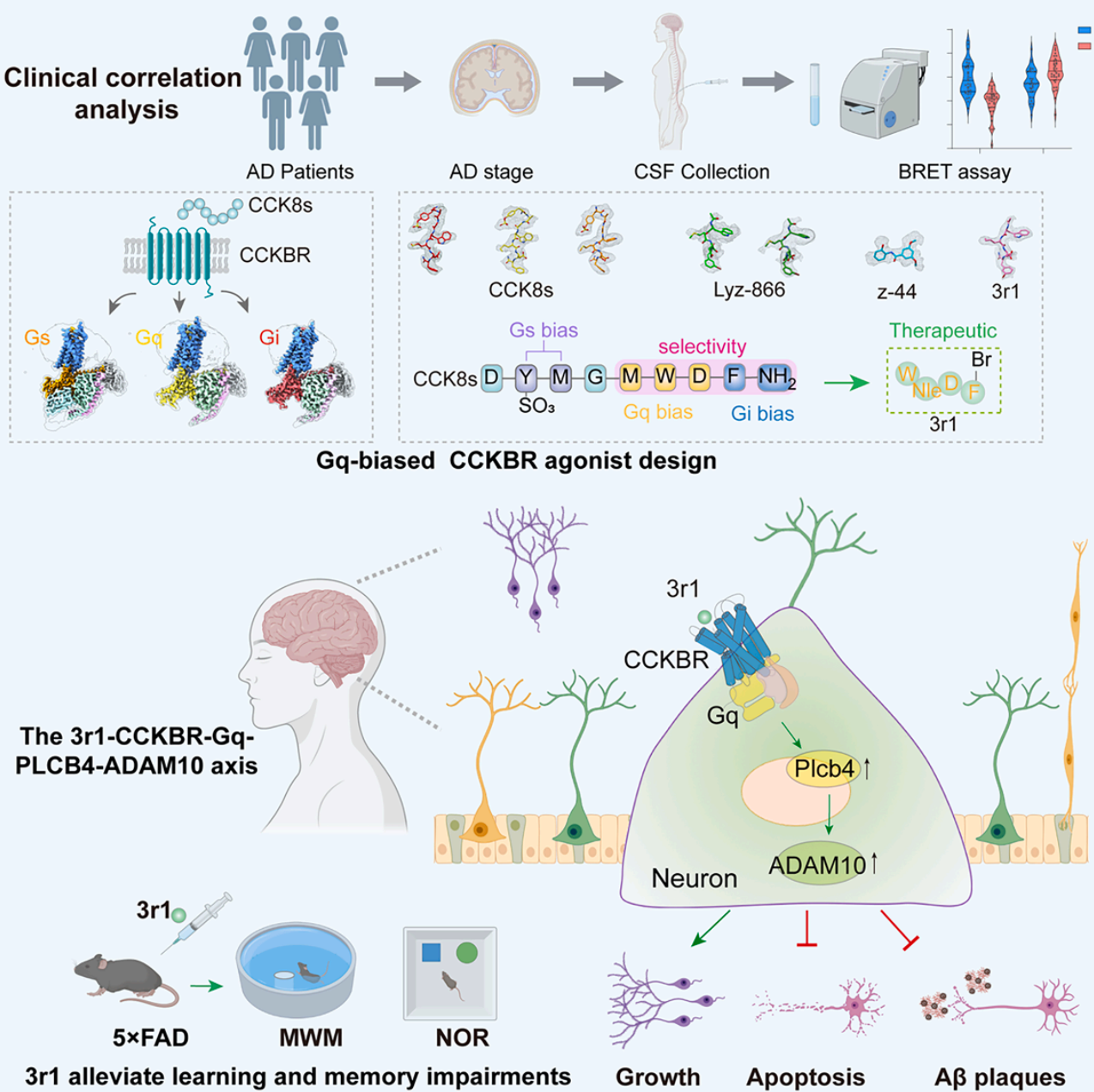
内嗅皮层是AD病理改变最早的脑区之一,常表现为神经原纤维缠结逐渐积累、明显萎缩及神经元丢失。研究团队首先发现,在5×FAD模型小鼠脑中,CCK信号通路出现异常,尤其是内嗅皮层区域CCK表达显著降低,而CCKBR受体表达则有所上升。
研究团队同时收集了78例处于不同认知阶段的AD患者脑脊液样本,发现重度痴呆患者脑脊液中的多肽成分对CCKBR的Gq信号激活能力明显低于轻度患者,而对Gi信号的激活能力则高于后者。这表明随着AD病情加重,CCKBR的Gq信号活性逐渐下降,而Gi信号活性则呈上升趋势。
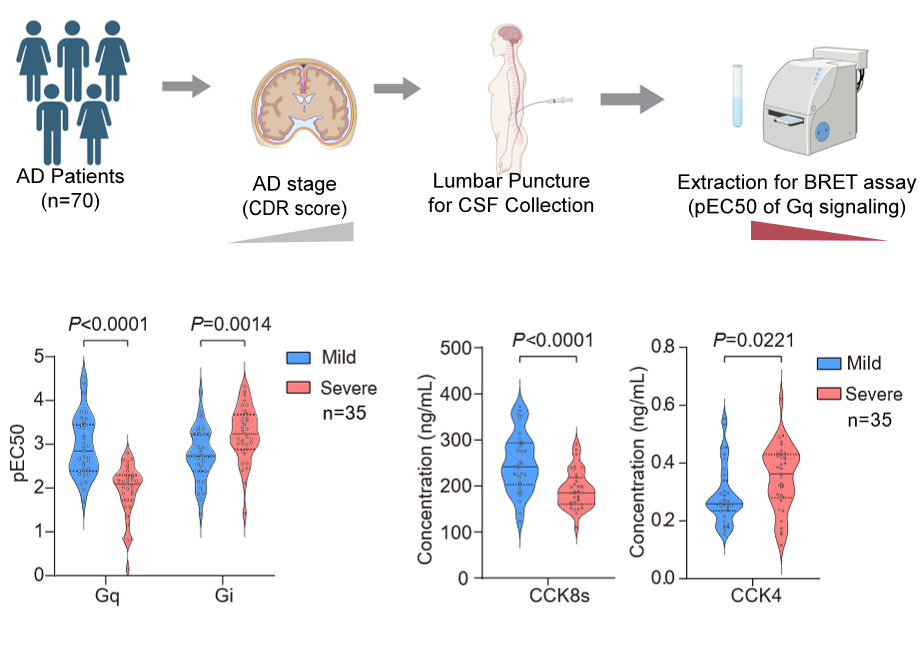
进一步实验显示,不同形式的CCK对CCKBR下游信号通路的激活存在差异:CCK8s、CCK8与Gastrin-17均能激活Gs、Gi和Gq三条通路,而CCK4仅激活Gi和Gq,不激活Gs。利用条件性基因敲除小鼠及病毒工具,研究人员阻断了Gs与Gq通路,发现这显著削弱了CCK8s对原代神经元细胞活力的恢复作用,而阻断Gi通路则未产生明显影响。这表明CCK8s通过Gs或Gq通路发挥神经保护作用,Gi通路并不参与该过程。临床样本分析进一步显示,AD严重程度与脑脊液中CCK8s水平下降及CCK4水平升高相关,提示CCKBR信号失衡可能参与AD病理进程。上述结果共同表明,CCKBR下游Gq信号通路在AD发展中具有正向调控作用,靶向该信号轴有望成为新的治疗策略。
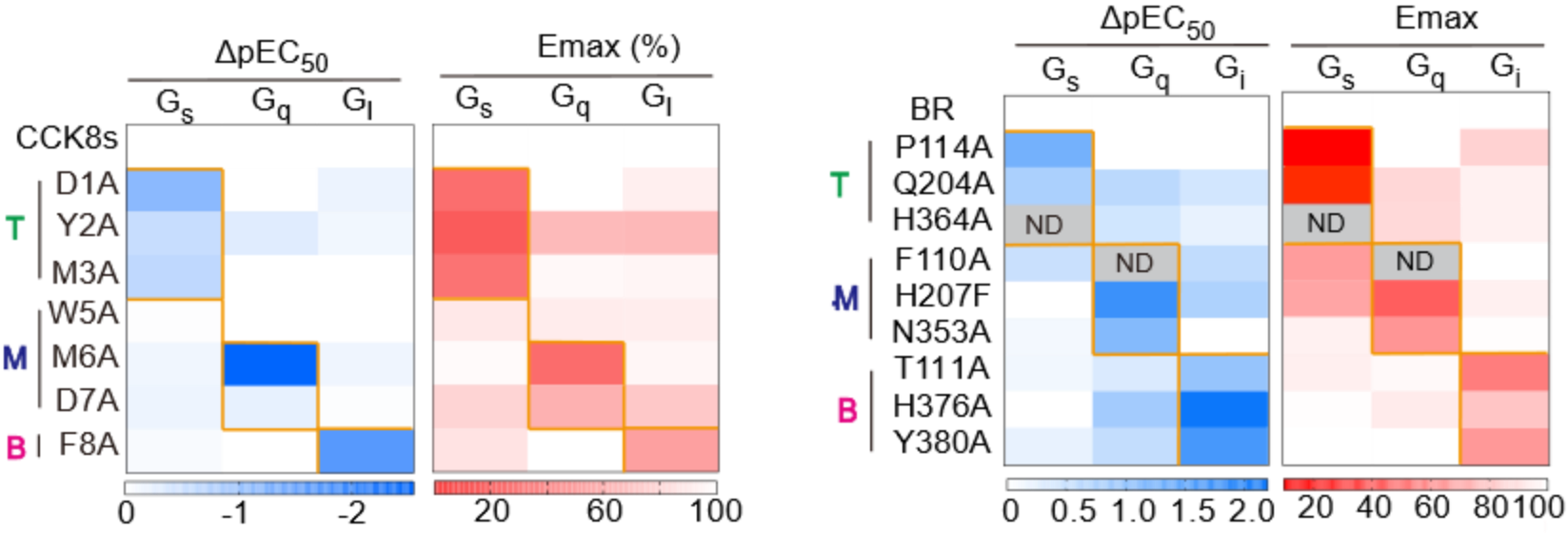
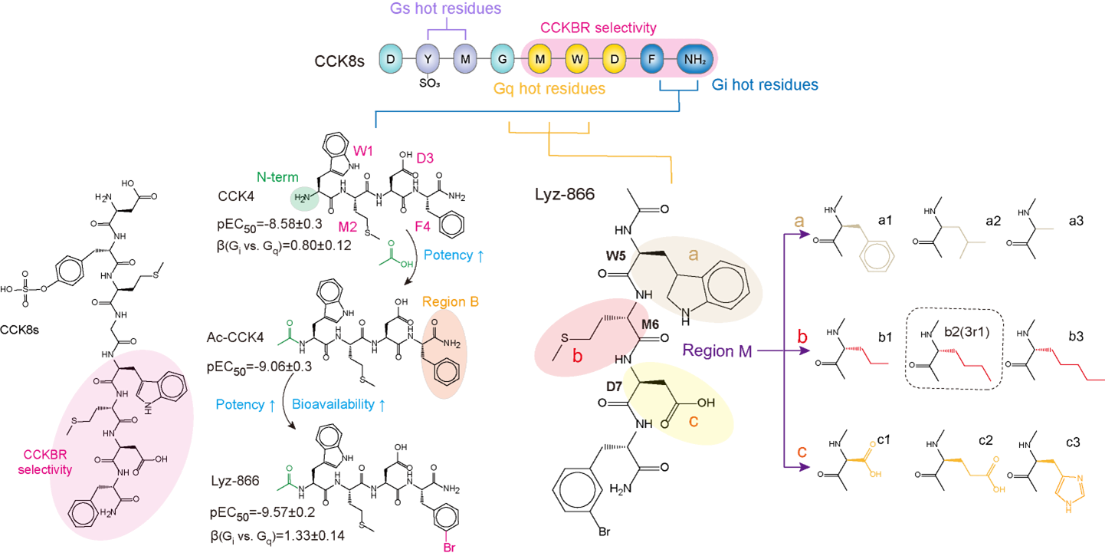
研究团队进一步利用冷冻电镜技术,成功解析了CCK8s与CCKBR及三种不同G蛋白(Gs/Gq/Gi)的复合物结构,发现CCK8s通过受体口袋中不同区域的残基引导特异性G蛋白偶联,其顶部、中部和底部分别主要介导Gs、Gq和Gi信号的传导。
基于上述结构机制,研究团队先后开发了Gi偏向性多肽激动剂Lyz-866、小分子激动剂z-44以及Gq偏向性激动剂3r1。其中,z-44完全丧失Gq/Gs活性,仅保留Gi信号,成为研究CCKBR-Gi功能的有力工具;而3r1在Lyz-866基础上通过DL-正亮氨酸替换甲硫氨酸,显著增强了其激活CCKBR-Gq信号的能力。更重要的是,与内源性配体CCK8s相比,Lyz-866、z-44和3r1均具备更好的血脑屏障穿透性和更长的半衰期。
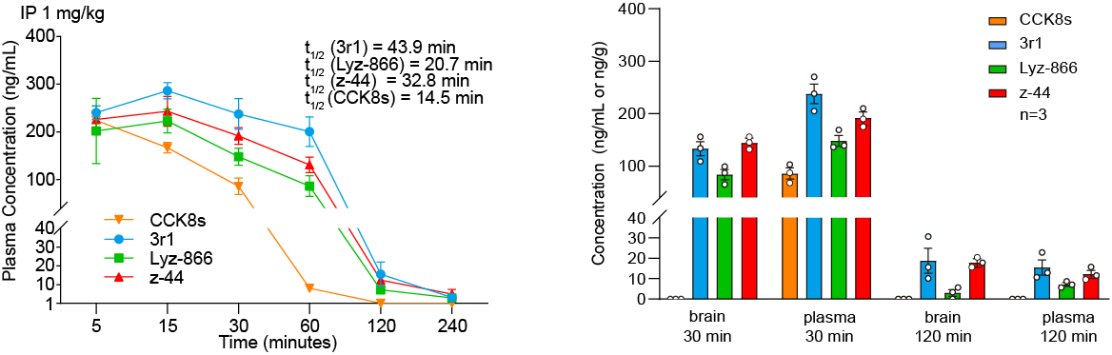
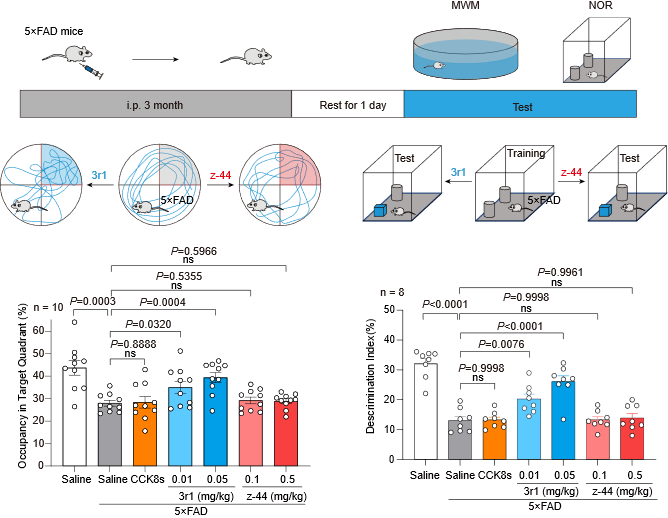
在5×FAD小鼠模型中,通过Morris水迷宫和新物体识别行为学测试,研究团队发现Gq偏向性CCKBR激动剂3r1能够显著改善小鼠的空间学习与记忆能力,促进海马长时程增强(LTP),并减少Aβ斑块沉积和Tau蛋白磷酸化。这一结果表明,靶向CCKBR的Gq偏向性激动剂3r1在改善AD相关认知缺陷方面具有明确的治疗效果。
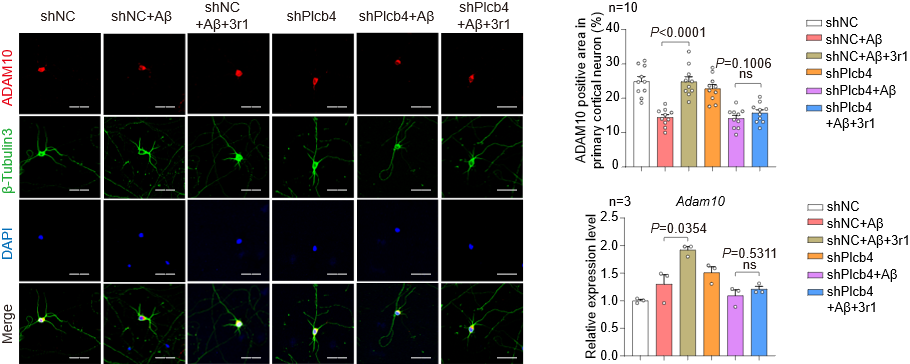
为阐明3r1改善认知功能的具体机制,研究团队通过转录组学分析与体外功能验证,筛选出磷脂酶Cβ4(PLCB4)作为3r1激活CCKBR-Gq信号通路后的关键下游分子。从Aβ代谢通路角度分析,3r1能特异性上调α-分泌酶ADAM10的基因和蛋白表达,并增加其产物sAPPα水平,从而引导淀粉样前体蛋白(APP)向非淀粉样蛋白生成途径加工。在原代神经元中,3r1通过激活CCKBR-Gq通路诱导PLCB4/ADAM10表达上调,进而发挥神经保护作用。这些结果共同确认ADAM10与PLCB4是3r1发挥神经保护作用的关键下游效应分子。
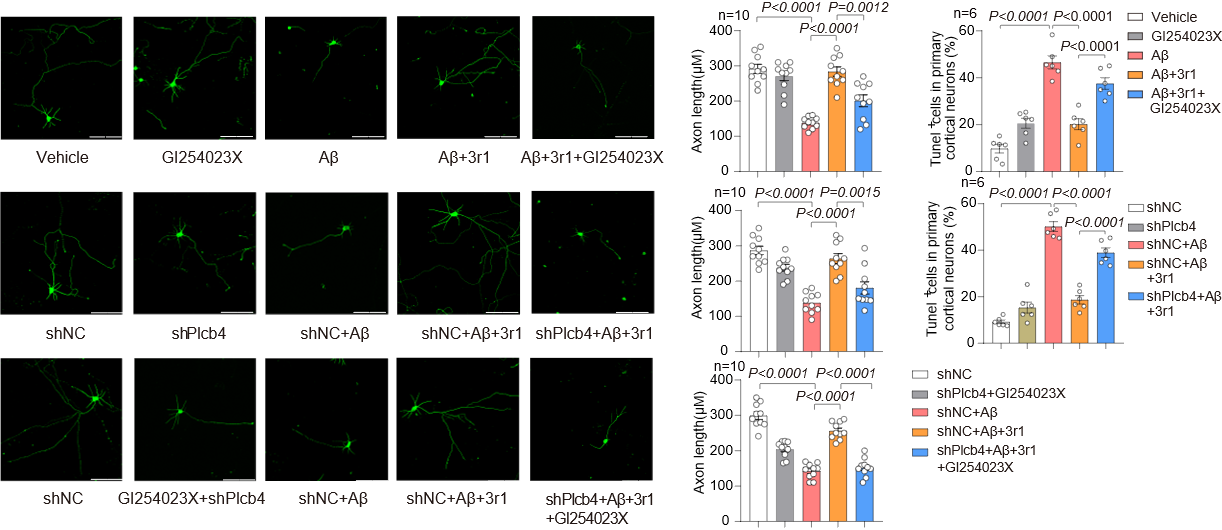
进一步机制研究表明,3r1对ADAM10的上调作用依赖于Gq信号和PLCB4的激活,从而揭示了一条全新的CCKBR-Gq-PLCB4-ADAM10信号轴,阐明了3r1通过激活该通路协同促进非淀粉样蛋白途径的APP加工、实现神经保护的分子机制。
综上所述,该研究首次揭示了CCKBR偏向性信号在AD治疗中的潜力,所开发的Gq偏向性激动剂3r1具备更优的药代动力学特性,为AD的精准治疗开辟了新方向。
北京大学医学部51直播 博士后王佳乐、沙雪莹博士,香港城市大学博士邵玥,山东大学51直播 博士生张自豪,暨南大学黄深明教授,51直播-51直播网 林慧研究员以及香港中文大学(深圳)博士甘师仪为本文的共同第一作者。北京大学孙金鹏教授,香港城市大学贺菊芳教授,北京大学张勇教授,铁璐副教授,香港中文大学(深圳)杜洋教授和北京宣武医院唐毅教授为本文共同通讯作者。
孙金鹏教授课题组长期聚焦于微环境药理学和感知觉药理学,系统性的研究了膜受体感知微环境并调控生理功能的机制,发现了感知听觉和平衡的GPCR膜受体,发现了类固醇激素膜受体亚家族,发现了神经酰胺的膜受体,开发了靶向1型糖尿病,特应性皮炎和增加肌肉质量的药物等,以通讯作者在Nature(x9),Science(x2,封面1篇),Cell(x6,封面1篇),Cell Metab(x2),Nature Metab(x2),Nat Chem Biol(x4),Cell Research(x4)等知名杂志发表110余篇论文,在膜受体对微环境感知和配体识别方面处于国际研究前沿。该项研究得到国家重点研发计划基金、国家杰出青年科学基金、自然基金委重点基金、重大项目、山东省重点研发计划、昌平实验室和新基石科学基金的支持。
原文链接://www.cell.com/cell/fulltext/S0092-8674(25)01238-3
参考文献:
[1]Vishwas S, Awasthi A, Corrie L, Kumar Singh S, Gulati M. Multiple target-based combination therapy of galantamine, memantine and lycopene for the possible treatment of Alzheimer's disease. Med Hypotheses 2020, 143: 109879
[2]Miculas DC, Negru PA, Bungau SG, Behl T, Hassan SSU, Tit DM. Pharmacotherapy Evolution in Alzheimer's Disease: Current Framework and Relevant Directions. Cells 2022, 12(1)
[3]Pardo-Moreno T, González-Acedo A, Rivas-Domínguez A, García-Morales V, García-Cozar FJ, Ramos-Rodríguez JJ, Melguizo-Rodríguez L. Therapeutic Approach to Alzheimer's Disease: Current Treatments and New Perspectives. Pharmaceutics 2022, 14(6)
[4]Huang LK, Chao SP, Hu CJ. Clinical trials of new drugs for Alzheimer disease. J Biomed Sci 2020, 27(1): 18
[5]Gandy S. Lifelong management of amyloid-beta metabolism to prevent Alzheimer's disease. N Engl J Med 2012, 367(9): 864-866
[6]Wei M, Wu T, Chen N. Bridging neurotrophic factors and bioactive peptides to Alzheimer's disease. Ageing Res Rev 2024, 94: 102177
[7]Kaji I. [Clinical aspects of psychosomatic disorders: a study from the viewpoint of Digestive system]. Hokkaido Igaku Zasshi 1985, 60(4): 464-467
[8]Sciślicki A, Gawel J, Bruździński H. [Abnormal IgG, IgA and IgM serum concentrations in chronic respiratory diseases in children. II. Abnormal patterns of serum immunoglobulins]. Pneumonol Pol 1976, 44(8-9): 859-868
[9]Bowers ME, Ressler KJ. Interaction between the cholecystokinin and endogenous cannabinoid systems in cued fear expression and extinction retention. Neuropsychopharmacology 2015, 40(3): 688-700
[10]Chhatwal JP, Gutman AR, Maguschak KA, Bowser ME, Yang Y, Davis M, Ressler KJ. Functional interactions between endocannabinoid and CCK neurotransmitter systems may be critical for extinction learning. Neuropsychopharmacology 2009, 34(2): 509-521
[11]杨胜昌. Tau和MAP-2在CCK-8减轻吗啡致空间记忆损害中的作用及机制研究. 2013.
[12]Chen X, Li X, Wong YT, Zheng X, Wang H, Peng Y, Feng H, Feng J, Baibado JT, Jesky R, Wang Z, Xie H, Sun W, Zhang Z, Zhang X, He L, Zhang N, Zhang Z, Tang P, Su J, Hu LL, Liu Q, He X, Tan A, Sun X, Li M, Wong K, Wang X, Cheung HY, Shum DK, Yung KKL, Chan YS, Tortorella M, Guo Y, Xu F, He J. Cholecystokinin release triggered by NMDA receptors produces LTP and sound-sound associative memory. Proc Natl Acad Sci U S A 2019, 116(13): 6397-6406
[13]Asim M, Wang H, Waris A, Qianqian G, Chen X. Cholecystokinin neurotransmission in the central nervous system: Insights into its role in health and disease. Biofactors 2024, 50(6): 1060-1075

